he氨基酸
唾液活性酶
Nat. Chem.:新型化学-酶促合成法助力人呼吸道病毒乙酰化唾液酸受体鉴定
本文来自微信公众号:X-MOLNews
新冠肺炎席卷全球的态势使得学界和广大民众对冠状病毒有了全新的认知。针对冠状病毒广泛而深入的研究确乎成为当今及未来基础研究和药物研发的主题。目前已有七种冠状病毒可感染人类,其中四种(OC43、HKU1、229E、NL63)在全球皆发生季节性流行,虽对健康成年人仅导致普通感冒,但对新生儿、老年人以及免疫低下人群仍可成为致命威胁(Trends Microbiol., 2016, 24, 490-502),其中以OC43尤甚(NEJM,2016, 375, 497-498)。病毒入侵宿主的关键在于其与受体的结合(图1),成功识别受体分子之后即可触发入侵机制。229E、NL63以及其他三种人类冠状病毒(SARS-CoV、MERS-CoV、SARS-CoV-2)均识别细胞表面的蛋白质,而OC43和HKU1则结合另一类受体分子——多糖。
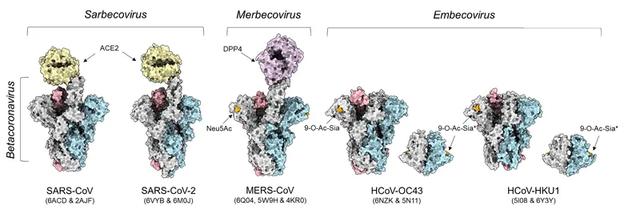
图1. 冠状病毒细胞受体示例。图片来源:@DanielHurdiss | Twitter
多糖对细胞而言既是士兵的铠甲也是模特的外衣,是细胞与外环境相互作用的关键。机体免疫细胞调节、受精作用以及微生物感染的过程都和多糖密不可分。与病原微生物的对抗和长期的进化过程造就了不同物种之间细胞糖衣的差异。这些差异形成了一道隐形的铠甲,可以抵御病原体跨宿主传播。唾液酸是一类特殊的糖分子,通常位于多糖的末端,糖衣的最外层,也就自然成为了细胞与外界交流的最前线。由于唾液酸的位置非常利于分子识别,许多病毒不约而同地进化出了盗用唾液酸多糖作为受体的能力,即通过识别含有唾液酸的多糖来入侵宿主细胞。流感病毒便是这些臭名昭著的“惯犯”之一,它们可以通过区分唾液酸分子与其他糖分子的连接方式来“辨别”合适的宿主:人类甲型流感病毒主要结合alpha-2,6-连接的唾液酸,而甲型禽流感病毒则偏好alpha-2,3-连接的唾液酸。这是因为前一种唾液酸多糖在人类上呼吸道的分布较为广泛,而后者则多富集于禽类的消化道。
唾液酸有多种分子型态,它的C4-、C7-、C8-以及C9-位羟基可以分别或同时被乙酰基修饰,从而生成十余种唾液酸的变体(图2)。有相当数量的病毒也可将这些唾液酸变体作为受体来开启细胞入侵。然而,研究者们对这些唾液酸变体与病毒相互作用的了解还远不及前文中对甲型流感病毒描述的那样透彻。前文提到,甲型流感病毒区分宿主的方式依赖于唾液酸与下游糖分子不同的连接方式(糖苷键),而对目前已知结合唾液酸变体的病毒——包括部分beta属冠状病毒(Embecovirus,新冠病毒的远亲)、凸隆病毒(Torovirus)丙型和丁型流感病毒——如何辨别不同宿主仍是悬而未决的问题。阻碍其研究的主要原因是这些糖分子非常不容获得和操控:一方面,研究者们对这些唾液酸变体的生物合成途径所知甚少,很难从基因工程学入手研究;另一方面,乙酰基的不稳定性极大的限制了天然提取或化学合成中可用的试剂和条件,以致于一部分唾液酸变体多糖曾经一度被认为是“几乎不可能”合成的分子(ACS Chem. Biol., 2010, 5, 163–176)。
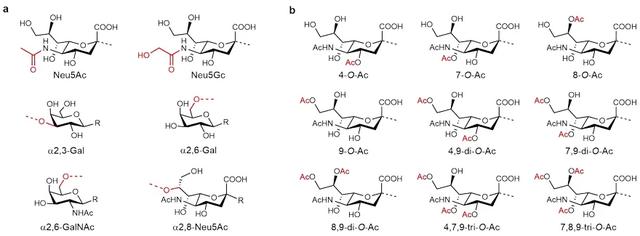
图2. 唾液酸寡糖结构及常见乙酰化变体。Neu5Ac, N-acetylneuraminic acid; Neu5Gc,N-glycolylneuraminic acid; Gal, galactose; Ac, acetyl。图片来源:Nat. Chem.
近日,荷兰乌特勒支大学的Geert-Jan Boons组和Raoul de Groot组于期刊Nature Chemistry 联合发表论文,他们利用Embecovirus的血凝素-酯酶(HE)囊膜蛋白,由一个合成前体出发,通过HE对唾液酸中的乙酰基高度选择性的剪切修饰,获得了六个不同的乙酰基唾液酸变体型。所合成的化合物库覆盖了脊索动物的几乎所有可能出现的乙酰化唾液酸变体多糖的末端结构。他们不仅报道了这类分子的首次合成,还将这些糖分子打印在糖微阵列芯片上用来表征上述多种病毒蛋白的结合特性,所涉及病毒宿主涵盖了包括人类在内的多种哺乳动物。实验发现人类冠状病毒OC43和HKU1尤其偏好含C9位乙酰化、alpha-2,8-糖苷键连接的唾液酸,并且通过细胞感染实验验证了含有该结构的细胞表面糖脂可以成功介导病毒的入侵。
乙酰化唾液酸寡糖的化学-酶促合成
本篇合成工作的挑战主要来自于唾液酸乙酰基的化学不稳定性以及alpha唾液酸糖苷键的选择性构建。前者体现在:1)C9位的乙酰基可在pH>8的条件下发生水解反应;2)C7和C8位的乙酰基在pH>7时可发生快速的重排(C7向C8、C9位迁移,C8向C9位迁移)。这些化学性质极大的限制了以往寡糖合成中可用的保护基引入和脱除条件,而对于可选保护基的限制又进而使高效构建alpha构型的唾液酸糖苷键成为了难题。这是因为在构建这个特殊的糖苷键时,我们无法使用端基邻位保护基的参与效应,而唾液酸四个羟基和C5位氨基上的保护基对电子的诱导效应均可对新手性中心的形成以及糖基氧鎓离子中间体的反应性产生影响,可导致不同程度的糖烯副产物以及beta糖苷键的生成。因此,alpha唾液酸糖苷键的化学合成通常需要尝试数种乃至数十种条件以达到预期的立体选择性和良好产率。由此可想,对于十余种乙酰化唾液酸变体而言,若对每种都分别进行条件筛选,合成将会非常繁冗。
作者预期以9-氧-苄基-5-氮-4-氧-羰基(或恶唑啉酮)保护的唾液酸基磷酸酯作为糖基供体或可解决唾液酸糖基化的立体选择性和产率问题;而运用HE蛋白来切除4,7,9-三乙酰化唾液酸多糖中的特定乙酰基,可陆续得到双乙酰化和单乙酰化变体。如此,对于一种唾液酸多糖的多种乙酰化变体,只需筛选出一种唾液酸糖基化的反应条件,从而大大的减少了可能的工作量(图3)。该篇工作运用了两种HE蛋白,分别来自牛冠状病毒(BCoV)和鼠肝炎病毒S株(MHV-S)。前者可以特异性切除C9位的乙酰基,后者则对C4位的乙酰基可选择性的水解。

图3. 乙酰化唾液酸寡糖合成策略。(a)由化学合成得到的alpha2,3/2,6/2,8-链接的唾液酸寡糖。(b)乙酰基可被HE选择性酶切。(c)糖基供体(4)和糖基受体(5-7)。图片来源:Nat. Chem.
基于以上策略作者对alpha-2,3/2,6/2,8-连接的三类唾液酸寡糖进行了化学组装。本文将以第一类为例,对关键步骤进行详细讨论(图4)。在唾液酸化反应中,糖基供体4和双羟基羰基受体5的交联可以高产率立体选择性得到三糖产物8。由于合成策略需要确保除唾液酸C4、C7及C8位以外的所有羟基在乙酸酐/吡啶反应条件(步骤F)的之前全部带有保护基,并且这些保护基还需满足1)引入条件温和,2)引入后对强碱条件稳定(步骤C),3)可以由催化氢化脱除(步骤G-i)。基于这几点考虑,作者在半乳糖C6位提前安装了萘-2-甲基,该基团可以在氧化剂DDQ的作用下发生分子内的环化反应生成缩醛9,从而以温和的条件在空间位阻大且反应性低的半乳糖C4位引入了满足上述所有条件的保护基。在一系列的脱保护操作后,可得到4,7,8-三乙酰化的唾液酸寡糖。经探索发现,该化合物可以在偏酸性的非质子溶剂条件下发生由C8向C9的乙酰基选择性迁移(步骤G-ii),可以此得到4,7,9-三乙酰化唾液酸寡糖1a。类似的的化学组装策略亦可通用于alpha-2,6和2,8-连接的唾液酸寡糖的合成。
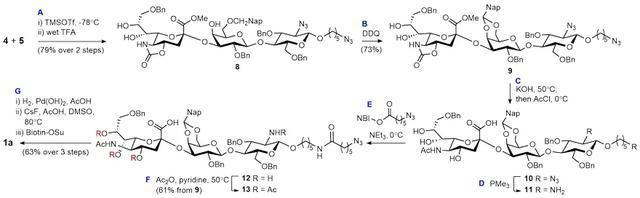
图4. 唾液酸寡糖合成示例。图片来源:Nat. Chem.
酶促乙酰基切除反应(图5)均在pH 6的缓冲溶液中进行,以确保没有水解或重排反应发生。当使用BCoV的HE与1a共孵育时,首先可得到4,7-双乙酰化的变体1b。以弱碱溶液处理1b之后,可生成4,9-双乙酰化型态1c。将1c继续以BCoV HE处理,可转变为4-单乙酰化型态1e。以MHV-S的HE处理化合物1a则得到7,9-双乙酰化的产物1d。S和BCoV HE反应可继而得到7位单乙酰化的变体1f。1f在弱碱性条件下可转化为9位乙酰化的变体1g。
图5. HE催化的乙酰基酶切。图片来源:Nat. Chem.
基于糖微阵列芯片的高通量筛选
上述唾液酸寡糖分子被打印于糖微阵列芯片上,并表征了15种感染不同宿主的病毒蛋白对糖受体的结合特性(图6)。这些蛋白包括人类、牛、马、狗、兔、鼠冠状病毒的刺突蛋白(S)和相应的HE,牛、猪凸隆病毒的HE,以及人类丙型(ICV)和猪丁型(IDV)流感病毒的血凝素-酯酶-膜融合蛋白(HEF)。HE和HEF蛋白均以无酯酶活性的突变体形式表达。
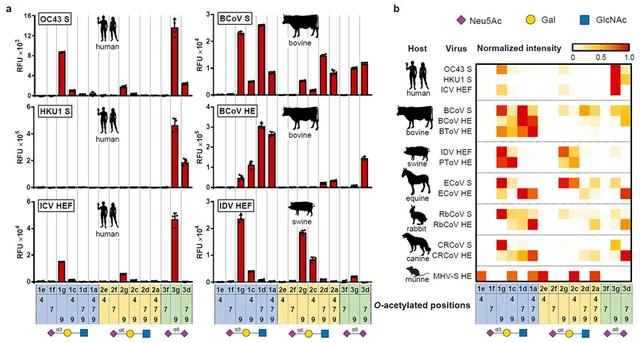
图6. 寡糖微阵列分析。(a)病毒蛋白结合特性柱状图。图下放表格中数字代表唾液酸乙酰基位点。(b)病毒蛋白结合特性热图。结合强度以最强结合为1.0进行了标准化。图中剪影代表宿主。图片来源:Nat. Chem.
人类冠状病毒OC43和HKU1的S蛋白和ICV的HEF蛋白均对9位单乙酰化的alpha-2,8-连接的双唾液酸显示强结合活性,而对其他乙酰化型态和糖苷键连接方式则结合减弱。其中HKU1的S蛋白对alpha-2,8-双唾液酸具有绝对选择性,几乎不结合其它唾液酸型态。感染其它哺乳动物的病毒的结合特点均不同于人类病毒,而相同宿主的不同病毒之间则显示出相似的结合特性。例如牛的冠状病毒与凸隆病毒均对含有7,9双乙酰化唾液酸的结合力均强于9位单乙酰化的型态;而猪的凸隆病毒和IDV则均偏好alpha-2,3/2,6-连接的9位单乙酰化和4,9-双乙酰化唾液酸型态。其余哺乳动物病毒也皆显示了不同于彼此的“结合指纹”。
此外,同种冠状病毒S和HE蛋白的结合偏好性也具有一定差异:S蛋白普遍对9-乙酰化型态结合能力强,而相应的HE蛋白则倾向结合含有7位乙酰基的双乙酰或三乙酰化的唾液酸变体。作者推测,导致该差异的主要原因是 S和HE蛋白职能不同:S蛋白主要负责结合细胞表面的糖受体,并随后介导病毒入侵;而HE则被用来协助病毒穿过位于上皮细胞表面的粘液层,防止病毒过度黏附于高度糖基化的粘蛋白而不能抵达上皮细胞表面。后续工作将对各哺乳动物宿主的上皮细胞表面以及粘蛋白层进行糖组学分析,以验证其各组分是否与S或HE蛋白的结合特性相契合。
人类冠状病毒关键细胞受体的验证
上文中提到人类冠状病毒OC43和HKU1和ICV偏好alpha-2,8-连接的双唾液酸,作者推断细胞表面含有该结构的糖缀合物(如糖脂、糖蛋白)或可介导病毒的入侵。这种双唾液酸结构在一类名为神经节苷脂的糖脂(ganglioside)中最为常见,例如GD3(CD60)分子。而GD3恰恰也可携带9位乙酰基的修饰。于是,作者向HEK293T细胞转染了GD3合成酶ST8Sia1,使得细胞在本源唾液酸9-乙酰化酶CASD1的共同作用下,可高表达9-乙酰化的GD3分子。当作者使用OC43和HKU1的S蛋白受体结合域S1A对细胞进行免疫荧光实验时(图7-a),发现OC43-S1A的荧光信号,在ST8Sia1转染之后可显著增强;HKU1-S1A则只能结合ST8Sia1转染后的细胞。这说明OC43-S1A对唾液酸受体的选择性较为宽松,而HKU1则对双唾液酸具有非常高的特异性,这均和糖微阵列结果相符。另外,若将S1A受体识别的关键氨基酸作丙氨酸突变,或用BCoV的HE预处理细胞,则均不能观察到荧光信号。
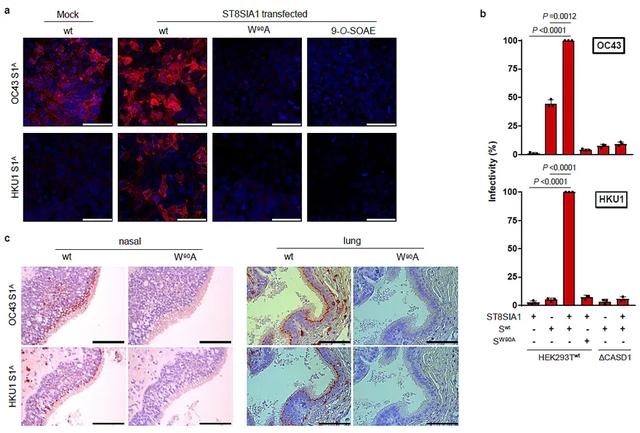
图7. 人类冠状病毒OC43和HKU1均以9-乙酰化alpha-2,8-双唾液酸为受体。(a)免疫荧光染色实验。W90A,S1A丙氨酸突变体对照;9-O-SOAE,BCoV HE预处理对照。(b)S蛋白包裹慢病毒感染实验。(c)人类呼吸道FFPE组织免疫组化染色实验。图片来源:Nat. Chem.
随后,作者利用这两种病毒S蛋白包被的慢病毒感染细胞(图7-b)。OC43可感染普通的HEK293T细胞,而对ST8Sia1高表达细胞的感染力有显著增强;HKU1则只能感染ST8Sia1高表达的细胞。若用携带上述丙氨酸突变的S蛋白包裹慢病毒,则不能观察到因病毒感染所产生荧光信号。同时,若使用CRISPR方法将CASD1敲除,使唾液酸不能携带乙酰基,亦未能观察到感染。
最后,通过使用两种病毒的S1A对人类上呼吸道以及肺部的FFPE切片进行免疫组织化学染色发现,OC43和HKU1的S1A均可对两种组织染色,而相应的丙氨酸突变体则失去了染色能力(图7-c)。这说明人类呼吸道确实表达有这两种病毒的受体,该发现与Jia 等人对人呼吸道糖组学质谱分析相符(Sci. Rep., 2020, 10, 5320)。
总结
该工作突破了乙酰化唾液酸寡糖合成的瓶颈,变“几乎不可能”为“简单高效”,大大助力了下游的病毒学发现。此前,OC43和HKU1的功能性受体一直存在争议,该工作发现并验证了其关键受体,为病毒跨宿主传染趋势预测和抗病毒药物研发提供了有力依据。此外,乙酰化唾液酸在诸多其他生物过程中均有涉及,比如固有和适应性免疫、肿瘤多重抗药性以及微生物感染,但其调节这些过程的分子机理均非常不明确。本工作无疑亦会对阐明乙酰化唾液酸的生物作用带来巨大推动力。
乌特勒支大学博士生李泽实和博士后郎一飞为本工作的共同第一作者。
Synthetic O-acetylated sialosides facilitate functional receptor identification for human respiratory viruses
Zeshi Li, Yifei Lang, Lin Liu, Mehman I. Bunyatov, Angelic Isaza Sarmiento, Raoul J. de Groot, Geert-Jan Boons
Nat. Chem., 2021, DOI: 10.1038/s41557-021-00655-9
新型化学-酶促合成法助力人呼吸道病毒乙酰化唾液酸受体鉴定,唾液活性酶

发表评论